Phản ứng H2SO4 + KCl → HCl + K2SO4
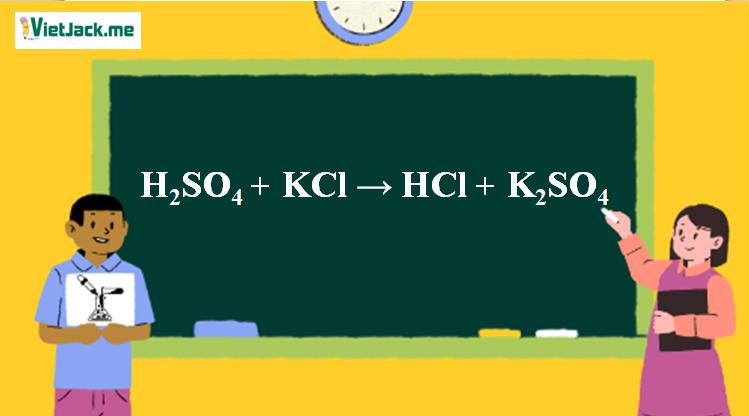
1. Phương trình phản ứng KCl tác dụng H2SO4 đặc
H2SO4 (đặc nóng)+ 2KCl 2HCl + K2SO4
2. Điều kiện phản ứng xảy ra KCl tác dụng H2SO4
Nhiệt độ: 500oC.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của KCl (Kali clorua)
KCl là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính tác dụng được với H2SO4.
3.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng với muối tạo thành axit mới và muối mới.
4. Tính chất hoá học của H2SO4
4.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
4.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Ứng dụng H2SO4
- Trong sản xuất phân bón:
Axit sunfuric được dùng chính trong để sản xuất axit photphoric, một nguyên liệu không thể thiếu để sản xuất các loại phân photphat. Và nó cũng được dùng để sản xuất Amoni sunfat.
- Trong sản xuất công nghiệp:
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,... và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ.
Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các dạng ắc quy, axit chì,...
Mỗi năm có khoảng 160 triệu tấn H2SO4 được sử dụng, nổ bật trong các ngành sản xuất như phân bón 30%, chất tẩy rửa 14%, giấy, sợi 8%, chất dẻo 5%, luyện kim 2%, phẩm nhuộm 2%, ...
- Trong xử lý nước thải:
Axit sunfuric được sử dụng để sản xuất nhôm hidroxit, chất được dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ các Ca2+, Mg2+, có trong nước thải.
Lưu ý: Về tác hại của axit sunfuric, đây là hóa chất nguy hiểm, hạng một ăn mòn và gây bỏng rộp da. Vì thế khi sử dụng nên trang bị đầy đủ các dụng cụ chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khio pha chế...
6. Tính chất hóa học của KCl
- KCl là một muối trung hòa nó mang đầy đủ tính chất hóa học của muối.
- Phân li toàn trong nước tạo thành các ion âm và ion dương:
KCl → K+ + Cl-
- Phản ứng với dung dịch chứa AgNO3
KCl + AgNO3 → AgCl ↓ + KNO3
- Kali Clorua là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính; do đó tương đối trơ về mặt hóa học.
- Phản ứng với H2SO4 đặc để tạo ra K2SO4 và HCL
2KCl + H2SO4 đặc → K2SO4 + 2HCl
- Kali clorua được sử dụng làm nguyên liệu để điều chế kim loại kali trong công nghiệp (thay thế bằng kim loại natri ở nhiệt độ cao 850 ° C
KCl + Na → K + NaCl
7. Bài tập vận dụng
Câu 1. Cho 2,4 gam kim loại M hóa trị II tác dụng H2SO4 sau phản ứng thu được 0,1 mol khí H2. Kim loại M là:
A. Zn
B. Fe
C. Mg
D. Cu
Lời giải:
Đáp án: C
Câu 2. Những tính chất sau, tính chất nào không phải tính chất của khí hiđroclorua?
A. Tan nhiều trong nước.
B. Tác dụng với khí NH3.
C. Tác dụng với CaCO3 giải phóng khí CO2.
D. Làm đổi màu giấy quỳ tím ẩm.
Lời giải:
Đáp án: B
Câu 3. Chỉ ra đâu không phải là đặc điểm chung của tất cả các halogen?
A. Nguyên tử halogen dễ thu thêm 1 electron.
B. Các nguyên tố halogen đều có khả năng thể hiện các số oxi hóa -1, +1, +3, +5, +7.
C. Halogen là những phi kim điển hình.
D. Liên kết trong phân tử halogen X2 không bền lắm, chúng dễ bị tách thành 2 nguyên tử halogen X.
Lời giải:
Đáp án: B
Câu 4. Phản ứng dùng để điều chế HCl trong phòng thí nghiệm là:
A. H2 + Cl2 → HCl.
B. AgNO3 + HCl → AgCl + HNO3
C. NaCl(r) + H2SO4 (đ) → NaHSO4+ HCl.
D. BaCl2 + H2SO4→ BaSO4 + HCl.
Lời giải:
Đáp án: C
Câu 5. Đặc điểm nào không phải là đặc điểm chung của các halogen
A. Tác dụng với hầu hết các kim loại và phi kim
B. Đều có tính oxi hóa mạnh
C. Đều là chất khí ở điều kiện thường
D. Khả năng tác dụng với nước giảm dần từ F2 đến I2
Lời giải:
Đáp án: C
